Un avance crucial para la química orgánica fue el concepto
de estructura química, desarrollado de forma independiente en 1858 por
Friedrich August Kekulé y Archibald Scott Couper (Brock, 2016; Lewis,
2002, 2010).
Ambos investigadores sugirieron que los átomos de carbono tetravalentes podrían
unirse entre sí para formar una red de carbono, y que los patrones detallados
de los enlaces atómicos podrían discernirse mediante interpretaciones hábiles
de las reacciones químicas apropiadas (Streitwieser,
Heathcock, & Kosower, 2017), y
resulta evidente que muchas de esas interpretaciones hábiles pasaban por los
cálculos de análisis de combustión que ya vimos en la sección de química
analítica (Enlace →).
En química, la
teoría estructural explica la gran variedad de compuestos químicos en términos
de átomos que componen moléculas, el orden en que los átomos se juntan en
moléculas y los electrones que los mantienen juntos. Según la teoría
estructural, a partir de la fórmula estructural de una molécula es posible
obtener datos físicos y espectroscópicos y predecir la reactividad química. A
partir de 1858, muchos científicos de varios países participaron en el
desarrollo temprano de la teoría estructural. Fue Butlerov quien acuñó la frase
"estructura química" en la siguiente cita de un artículo publicado en
1861: “... la naturaleza química de una molécula compuesta depende de la
naturaleza y cantidad de sus componentes elementales y su estructura química” (Harré, 2003; LEICESTER, 1966; Lewis,
2010; Rouvray, 1971).
Figura 5‑1 Archibald Scott Couper. Químico
escocés que propuso una nueva teoría de la estructura química y la vinculación.
Descubrió la tetravalencia del átomo de carbono, la cual le permite enlazar con
otros átomos de Carbono formando largas cadenas, y que el orden de enlace de
los átomos de una molécula puede determinarse a partir de indicios químicos.
Componentes de las estructuras
Lo átomos pueden formar un número de enlaces fijo, en
especial en la química orgánica. Por
ejemplo, el carbono es tetravalente, el oxígeno es divalente, el hidrógeno y
generalmente los halógenos son monovalentes. En términos de simbología las
valencias se traducen como poder de enlace o simplemente “palitos que permiten
vincular sustancias”.
El carbono y otros átomos pueden usar uno o más de sus
enlaces de valencia para unirse unos a otros. Sin embargo, de entre todos los
elementos, el carbono es el que expone esta capacidad en su máxima y más
diversa expresión. El carbono puede unirse a sustancias con cargas positivas
marcadas como los iones litio(1+) o sodio(1+) así como a sustancias con cargas
negativas marcadas como el oxígeno y los halógenos. A demás de eso puede unirse
con otros átomos de carbono con diferentes números de enlace.
Fórmulas
estructurales
Las fórmulas estructurales buscan representar la
conectividad y distribución de los átomos al interior de la molécula, pero
igual hay varios tipos.
Balones
y palos
En química, el modelo bolas-y-palos es un modelo molecular
de una sustancia química que sirve para mostrar tanto la posición
tridimensional de los átomos y los enlaces entre ellos. Los átomos están
típicamente representados por esferas daltonianas, conectadas por varillas que
representan los enlaces.
Los enlaces dobles y triples suelen estar representados por
dos o tres barras curvadas, respectivamente, aunque esto no represente
adecuadamente las entidades matemáticas que predicen sus formas en el espacio
llamadas orbitales. En un buen modelo, los ángulos entre las varillas deben ser
los mismos que los ángulos entre los enlaces, y las distancias entre los
centros de las esferas deben ser proporcionales a las distancias entre los
correspondientes núcleos atómicos. El elemento químico de cada átomo se indica
a menudo por el color de la esfera.
En un modelo de bolas-y-palos, el radio de las esferas es
generalmente mucho menor que las longitudes de varilla, con el fin de
proporcionar una visión más clara de los átomos y los enlaces a lo largo del
modelo. Como consecuencia, el modelo no proporciona una visión clara sobre el
espacio ocupado por la molécula. En este aspecto, los modelos de bolas-y-palos
son distintos de los modelos de llenado de espacio (Calotte), donde los radios
de la esfera son proporcionales a los radios atómicos en la misma escala que
las distancias de los átomos y, por tanto, muestran el espacio ocupado, pero no
los enlaces. Los modelos de bolas-y-palos pueden ser artefactos físicos o
modelos de computadora virtual. Los primeros se construyen generalmente a
partir de kits de modelado molecular, que consta de varios resortes
helicoidales o varillas de plástico flexible, y una serie de bolas de plástico
con orificios preperforados. Los colores de la esfera comúnmente siguen la
coloración CPK. Algunos cursos universitarios sobre química requieren que los
estudiantes compren estos modelos como material de aprendizaje.
En 1865, el
químico alemán August Wilhelm von Hofmann fue el primero en fabricar modelos
moleculares de bolas-y-palos.
Él usó tales modelos en la conferencia en la institución real de Gran Bretaña (Coleman, 2014; Zeinalipour-Yazdi, Pullman, &
Catlow, 2016).
Modelos
de Lewis o punto-enlace
Figura 5‑4. Modelos de punto y enlace. Los pares de electrones entre átomos representan enlaces, y los pares de electrones libres los no enlazantes, aquí aplicamos la ley del octeto, excepto para el hidrógeno.
Son diagramas que muestran la unión entre los átomos de una
molécula y los pares solitarios de electrones que pueden existir en la
molécula.
Se puede dibujar una estructura de Lewis para cualquier
molécula unida covalentemente, así como para compuestos de coordinación. La
estructura de Lewis fue nombrada después de Gilbert N. Lewis, que lo introdujo
en su artículo de 1916 el átomo y la molécula.
Las estructuras de Lewis pueden ser dos tipos, las mas comunes son las
de punto-enlace “imagen anterior” que representan a todos los electrones como
puntos, pero también pueden ser de enlace y electrón donde los electrones compartidos
que forman enlaces se representan como vínculos o líneas, cada línea representa
dos electrones enlazantes.
Las estructuras de Lewis muestran cada átomo y su posición
en la estructura de la molécula usando su símbolo químico. Las líneas se
dibujan entre átomos que están unidos entre sí (se pueden usar pares de puntos
en lugar de líneas). El exceso de electrones que forman pares solitarios se
representan como pares de puntos y se colocan junto a los átomos. Aunque los
elementos del grupo principal del segundo período y más allá reaccionan
generalmente ganando, perdiendo o compartiendo electrones hasta que han logrado
una configuración de electrón de la cáscara de valencia con un octeto completo
de electrones, otros elementos obedecen reglas diferentes. El hidrógeno (H)
sólo puede formar enlaces que compartan sólo dos electrones, mientras que los
metales de transición a menudo se ajustan a un duodecteto.
Fórmula
de barra y enlace
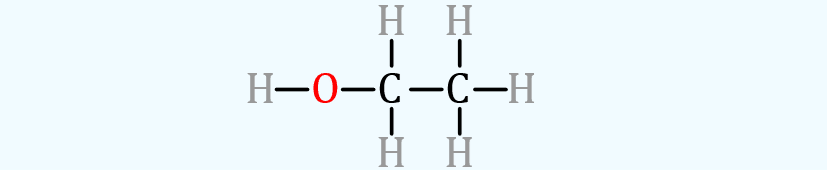
En las fórmulas de líneas se representa cada pareja de
electrones enlazantes covalentes como una línea, pero los enlaces iónicos se
siguen representado con una expresión de punto-enlace o simplemente
representando las cargas del dipolo iónico. En resumen, solo presentamos como
líneas los enlaces covalentes y covalentes polares. En ocasiones los electrones
no enlazantes también se presentan como puntos. Básicamente es una estructura
de enlace de Lewis sin los electrones desapareados. Se denomina completa debido
a que se representan todos los átomos en l molécula, lo cual para las moléculas
orgánicas resulta un poco molesto, debido a la gran cantidad de hidrógenos que
hay.
Figura 5‑5.
Modelo de barra y enlace. Por mucho son lo más común que vamos a
tener en este capítulo introductorio, cada enlace representa a dos electrones
compartidos.
Fórmula
de esqueleto
La fórmula esquelética, también llamada fórmula lineal o
fórmula taquigráfica, de un compuesto orgánico es un tipo de fórmula
estructural molecular que sirve como representación abreviada de la unión de
una molécula y algunos detalles de su geometría molecular.
Una fórmula esquelética muestra la base de una molécula, que
se compone de los átomos de carbono que forman la molécula. Se representa en
dos dimensiones, como en una página de papel. Emplea ciertas convenciones para
representar átomos de carbono e hidrógeno, que son los más comunes en química
orgánica, así como la tridimensionalidad si es necesario.
La técnica fue
desarrollada por el químico orgánico Friedrich August Kekulé von Stradonitz.
Las fórmulas esqueléticas se han vuelto omnipresentes en la química orgánica,
en parte porque son relativamente rápidas y fáciles de dibujar. Pueden
considerarse estructuras de Lewis abreviadas observando las siguientes
convenciones:
👉 un átomo de
carbono se indica como el término de un segmento de línea o el punto de
encuentro de segmentos de línea;
👉 los átomos de
hidrógeno conectados a los átomos de carbono no se muestran, sino que están
implícitos, de modo que cada átomo de carbono está unido al número de átomos de
hidrógeno que satisfaría la regla del octeto “en términos practicos es
satisfacer el poder de enlace de cada átomo, por ejemplo, para el carbono es 4,
para el nitrógeno es 3 o para el oxígeno 2”, o de otra manera mantener la
consistencia con la carga formal y el número de Electrones no enlazantes en el
carbono;
👉 heteroátomos y
átomos de hidrógeno unidos a ellos se muestran como un solo grupo (por ejemplo,
OH, NH2) sin mostrar explícitamente los enlaces heteroátomo -
hidrógeno;
👉 se muestran
opcionalmente pares de electrones no unidos en heteroátomos. Como en una
estructura de Lewis, un segmento de línea doble o triple indica unión doble o
triple, respectivamente.
Aunque las
proyecciones de Haworth y las proyecciones de Fischer parecen algo similares a
las fórmulas esqueléticas, existen diferencias en las convenciones utilizadas,
que el lector necesita conocer para comprender los detalles de una molécula.
Adicionalmente, las fórmulas de esuqleto serán las formulas estructurales
preferidas a todo lo largo de la química orgánica, así que la describiremos con
mayor profundidad en el siguiente capítulo.
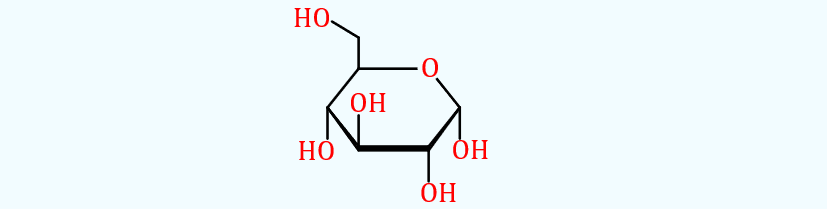
Proyecciones de Haworth
Una proyección
de Haworth es una forma común de escribir una fórmula estructural para
representar la estructura cíclica de los monosacáridos con una perspectiva
tridimensional simple. La química orgánica y especialmente la bioquímica son
las áreas de la química que más utilizan las proyecciones de Haworth.
Figura 5‑7.
Proyección de Haworth para la glucosa. Se usa para modelar azúcares cíclcicos.
La proyección de Haworth fue nombrada en honor del químico
inglés Sir Norman Haworth. Una proyección de Haworth tiene las siguientes
características:
👉 El carbono es el
tipo implícito de átomo. En el ejemplo anterior los átomos numerados de 1 a 6
son todos átomos de carbono. El carbono 1 se conoce como carbono anomérico;
👉 Los átomos de
hidrógeno en el carbono están implícitos. En el ejemplo, los átomos 1 a 6
tienen átomos de hidrógeno adicionales no representados;
👉 Una línea más
gruesa indica los átomos que están más cerca del observador. Los átomos 2 y 3
(y sus correspondientes grupos OH) son los más cercanos al observador. Los
átomos 1 y 4 están más alejados del observador. El átomo 5 y los otros átomos
son los más lejanos;
👉 Los grupos por debajo del plano del anillo en las
proyecciones de Haworth corresponden a los del lado derecho de una proyección
de Fischer. Esta regla no se aplica a los grupos en los dos carbonos del anillo
unidos al átomo de oxígeno endocíclico.
Proyecciones de Fischer
La proyección
de Fischer, ideada por Hermann Emil Fischer en 1891, es una representación
bidimensional de una molécula orgánica tridimensional por proyección. Las
proyecciones de Fischer fueron propuestas originalmente para la representación
de carbohidratos y usadas por los químicos, particularmente en química orgánica
y bioquímica. El uso de proyecciones de Fischer en no carbohidratos no es
aconsejable, ya que tales dibujos son ambiguos cuando se confunden con otros
tipos de moléculas.
Isómeros,
la importancia de las fórmulas estructurales
La teoría estructural les permitió a los primeros químicos
orgánicos comenzar a resolver varios problemas fundamentales que los acosaban.
En especial el problema del isomerismo. Estos químicos frecuentemente se
encontraban con ejemplo de diferentes sustancias que tenían las mismas formulas
moleculares pero que presentaban propiedades físicas y/o químicas diferentes. A
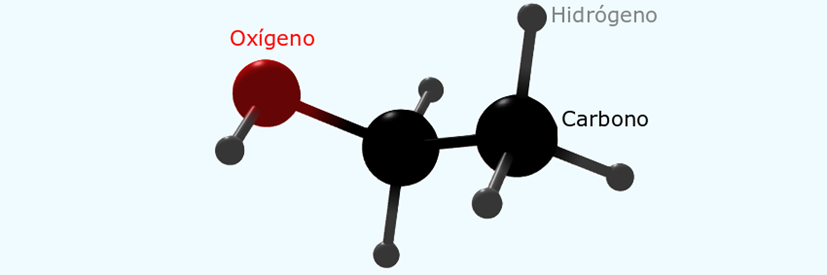
estas sustancias se las denominó isómeros. Consideremos un ejemplo. Tenemos dos
compuestos con la formula molecular C2H6O que son
claramente diferentes debido a sus diferentes propiedades.
Observe que estos dos isómeros poseen puntos de ebullición y
por eso uno es un gas a temperatura ambiente y el otro es un líquido. Debido a
que la fórmula molecular de ambos compuestos es la misma, esta no nos sirve
para entender las diferencias entre las propiedades físicas de ambas
sustancias. La teoría estructural remedia esta situación al adjudicarle a cada
sustancia una fórmula estructural diferente, con diferentes tipos de conexiones
entre los átomos.
Posteriormente en 1874 las formulas estructurales originadas
por kekulé, Couper y Butlerov fueron expandidas a las tres dimensiones por
medio de trabajos independientes de JD
van´t Hoff y JA Le Bel. Ambos propusieron que los hidrógenos en la molécula del
metano (CH4) se encontraban dispuestos como si estuvieran apuntando
a las puntas de un polímero regular llamado tetraedro. Hasta entonces a la
molécula de metano se la dibujaba plana como si fuera una cruz. El conocimiento
de la disposición en tres dimensiones de las moléculas es vital para el
entendimiento de la química orgánica y cualquier otra ciencia que dependa de
ella como la bioquímica.

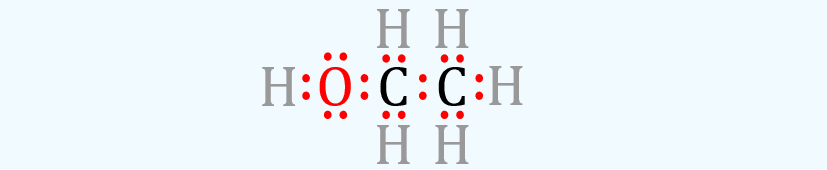

No hay comentarios:
Publicar un comentario