| Ciencias de Joseleg | Química | Química orgánica | Alquenos | (Introducción) (Doble enlace) (Nomenclatura) (Propiedades físicas) (Propiedades químicas) (Terpenos) (Grasas y aceites) (Plástico) (Acumulación del plástico) (Plástico y salud humana) (Futuro del plástico) (Referencias)
¡Los
químicos orgánicos han descubierto o fabricado más de 10 millones de compuestos
orgánicos! y muchos de
ellos no necesariamente naturales, en el sentido de que existan como producto
de la síntesis de seres vivos, por lo que muchas de las sustancias orgánicas
que producimos, nunca han estado en la naturaleza.
Parecería
una tarea casi imposible aprender las propiedades químicas de tantos
compuestos. Afortunadamente, el estudio de los compuestos orgánicos no es una
tarea tan formidable como podría pensarse. Aunque los compuestos orgánicos
pueden experimentar una amplia variedad de reacciones químicas, solo ciertas
porciones de sus estructuras se modifican en una reacción en particular. Como
veremos en este capítulo, el mismo grupo funcional, en cualquier molécula
orgánica que lo encontremos, sufre los mismos tipos de reacciones químicas. Por
lo tanto, no tienes que estudiar las reacciones químicas de ni siquiera una
fracción de los 10 millones de compuestos orgánicos conocidos. En cambio, solo
necesita identificar algunos tipos característicos de grupos funcionales y
luego estudiar las reacciones químicas que experimenta cada uno.
En las
pruebas de Estado, como los exámenes saber 11 En Colombia, un tipo de preguntas
muy común para la sección de química, es la aplicación de las propiedades
químicas de las moléculas orgánicas sobre una fórmula estructural de un
reactivo, para determinar la fórmula estructural de un producto. La buena
noticia es que el propio enunciado nos dará un ejemplo o una estructura
generalizada. Por lo tanto, lo importante en esta sección es aprender a aplicar
las estructuras generalizadas a un ejemplo particular.
Reactividad del doble
enlace
La principal diferencia con los alcanos radica en las
propiedades químicas, los enlaces pi del doble enlace y el triple enlace son
(1) de alta energía y (2) muy inestables, por lo que, si le va a ocurrir una
reacción al alqueno o alquino, el punto de ataque será el doble o triple
enlace. La mayoría de las veces se conserva un enlace entre carbonos que es el
tipo sigma estable, pero los restantes se abren para recibir grupos
sustituyentes, la clave es saber cuál de los dos carbonos de un doble enlace lo
recibirá con más frecuencia, y
allí es donde entran las reglas de Markovnikov/Zaitsev y anti-Markovnikov/Zaitsev.
Niveles de los carbonos
Los químicos orgánicos, con la química del carbono como
tema, han desarrollado todo tipo de frases abreviadas para describir
estructuras y fenómenos que, de otro modo, requerirían una oración de dos para
explicar. Aquí está el ejemplo de hoy: la terminología de los grupos
funcionales que contienen carbono: primario, secundario, terciario,
cuaternario.
👉
Los carbonos primarios son carbonos
unidos a un carbono. Esos carbono son los más fáciles de
identificar porque son los carbonos terminales en una cadena de hidrocarburo y
por lo tanto presentan 3 hidrógenos.
👉
Los carbonos secundarios están unidos a otros dos
carbonos.
👉
Los carbonos terciarios están unidos a otros tres
carbonos.
👉
Finalmente, los carbonos cuaternarios
están unidos a otros cuatro carbonos.
Básicamente
a mayor nivel de carbono, menor cantidad de hidrógenos.
La regla de Markovnikov
para adiciones
Cuando se adicionan sustancias de cargas opuestas a un
alqueno:
👉
la parte negativa se une al carbono de mayor nivel, es decir, el que tiene
menos hidrógenos; mientras que
👉 la parte positiva se une al carbono de menor nivel, siendo este el que
tiene mayor cantidad de hidrógenos.
Por tal razón, identificar el tipo de carbono es vital para
poder predecir el isómero generado en una reacción de adición. Algunas propiedades químicas pueden
llegar a ser anti-Markovnikov, y predecir eso es imposible, por lo que debe ser
determinado experimentalmente y por lo tanto indicado en el enunciado de la
propiedad química específica.
5.1
Regla de Markovnikov: En una adición Markovnikov la parte
negativa se adiciona al carbono de doble enlace con menos hidrógenos, y la
parte positiva al carbono con más hidrógenos. El elemento positivo M puede ser
un metal, hidrógeno o un grupo alquilo. El elemento negativo X puede ser un
halógeno o un grupo oxigenado como hidroxilo.
Con tenga en cuenta que si los 2 carbonos involucrados en la habitación tienen el mismo nivel es probable que se generen 2 isómeros diferentes.
La regla de Zaitsev para eliminaciones
En reacciones de eliminación para la formación de un doble
enlace,
👉 el carbono preferente para la
generación del doble enlace será aquel con menor cantidad de hidrógenos, es decir, aquel
que tenga mayor nivel.
5.2
Halogenación en seco o síntesis de dihaluros de
alquilo.
Los alquenos reaccionan rápidamente con los gases diatómicos
del cloro y el bromo para formar dihaluros de alquilo.
5.3
En los alquinos la halogenación tiende a generar el isómero
trans al ser el más estable. Este proceso también ocurre en los alquinos.
Hidrohalogenación de alquenos o síntesis de
haluros de alquilo.
Los ácidos hídricos o también conocidos como los haluros
dehidrógeno (HI, HBr, HCl y HF) se pueden adicionar a un alqueno en su región
de doble enlace. Como la mayoría de las adiciones, esta sigue la regla de
Markovnikov en caso de que los dos carbonos del doble enlace presenten niveles
diferentes.
5.4
Halohidratación o síntesis de halo-alcoholes
El tratamiento de un alqueno con dibromo o dicloro en
presencia de agua da como resultado la adición de OH y Br, o, OH y Cl, al doble
enlace carbono-carbono para dar lugar a una halohidrina.
5.5
El grupo hidroxilo y el halógeno se consideran negativos,
pero entre ellos, el hidroxilo es más negativo que el halógeno, y, por ende, el
hidroxilo se acopla al carbono más reactivo o con menos hidrógenos siguiendo la
regla de Markovnikov.
Hidratación o síntesis de alcoholes
Las hidrataciones son reacciones en las que generalmente se
adiciona un grupo hidroxilo a la cadena de carbonos, en otras palabras,
sintetizan alcoholes. Esta hidratación es especialmente útil en la síntesis de
alcoholes de bajo peso molecular a nivel industrial, aunque en algunas
ocasiones pueden sintetizarse alcoholes no deseados debido al fenómeno de
reorganización.
Como se puede deducir del título, los catalizadores son
ácidos, en este caso ácido sulfúrico o ácido fosfórico. ¿Alguien nota algo
extraño aquí? Nuevamente tenemos ácido sulfúrico en la mezcla, por lo que,
¿Cómo diferenciamos cuando el ácido sulfúrico genera una hidratación catalizada
por ácidos o una adición de grupo bisulfato?
La clave es el calor. De hecho, ambas reacciones ocurren, o
mejor dicho sucede una cadena de reacciones de dos pasos, en primera instancia
se da la adición del grupo bisulfato según la regla de Markovnikov si el
alqueno no es simétrico, y luego al calentar la mezcla el grupo bisulfato se
desprende regenerando su forma ácida, mientras que el carbono libre recibe el
grupo hidroxilo proveniente del agua.
5.6
El ácido sulfúrico es un catalizador que interviene en el
mecanismo de la reacción, el verdadero reactivo es el agua, que se divide en un
grupo hidroxilo que se une al carbono con menos hidrógenos y un hidrógeno que
se une al carbono con más hidrógenos, esta reacción solo ocurre en caliente,
pues en frio se gen era un producto diferente.
Hidrogenación
Es una reacción homóloga a la halogenación.
5.7
Clivaje oxidativo, síntesis de ácidos, aldehídos
y cetonas
Clivaje significa corte, Los clivajes oxidativos se
diferencian de las adiciones en el sentido de que afectan los dos enlaces del
alqueno, tanto el enlace pi como el enlace sigma. En otras palabras, el alqueno
se corta a la altura del enlace doble. La sustancia generada depende del tipo
de carbono:
(1) Si es un carbono primario se genera dióxido de carbono;
5.8.
(2) Si es un carbono secundario se genera un ácido
carboxílico;
5.9.
En este caso hay dos carbonos secundarios.
y (3) Si es un carbono terciario se genera una cetona.
5.10.
En este caso tenemos un carbono terciario y un carbono
secundario.
En los alquinos el doble triple enlace al igual que el doble
puede ser un sitio de ataque para la oxidación, en este caso en forma del
rompimiento de la cadena para formar ácidos carboxílicos. Esto se logra o con
oxígeno o con permanganato de potasio.
Polimerización
Una de las
reacciones técnicas más importantes de los alquenos es su conversión en
compuestos alargados y altamente repetitivos llamados polímeros. Un polímero se
define como una molécula de cadena larga con unidades estructurales
recurrentes. Por lo tanto, la polimerización del propeno da un hidrocarburo de
cadena larga con unidades recurrentes.
5.11. Un ejemplo es el polietileno, que es básicamente un alcano lineal y muy largo sintetizado a partir de eteno.
En los compuestos químicos, la polimerización puede ocurrir a través de una variedad de mecanismos de reacción que varían en complejidad debido a los grupos funcionales presentes en los reactivos y sus efectos estéricos inherentes. De todos los procesos de polimerización posibles los más sencillos, y por ende los que tienen menores costos energéticos y monetarios, son aquellos que involucran a los alquenos.
Figura 5‑1. Un ejemplo de polimerización de alquenos, en el que el doble enlace de cada monómero de estireno se reforma como un enlace simple más un enlace a otro monómero de estireno. El producto es poliestireno.
Como los
alquenos pueden polimerizarse en reacciones de radicales algo sencillas, forman
compuestos útiles como el polietileno y el cloruro de polivinilo (PVC), que se
producen en grandes cantidades cada año debido a su utilidad en los procesos de
fabricación de productos comerciales, como como tubería, aislamiento y
embalaje. En general, los polímeros como el PVC se denominan
"homopolímeros", ya que consisten en cadenas largas repetidas o
estructuras de la misma unidad monomérica, mientras que los polímeros que
constan de más de una unidad monomérica se denominan copolímeros.
La
polimerización que no está lo suficientemente moderada y avanza a un ritmo
rápido puede ser muy peligrosa. Este fenómeno se conoce como polimerización
peligrosa y puede provocar incendios y explosiones.


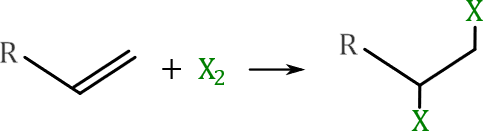









No hay comentarios:
Publicar un comentario