| Ciencias de Joseleg | Química | Química orgánica | Alquenos | (Introducción) (Doble enlace) (Nomenclatura) (Propiedades físicas) (Propiedades químicas) (Terpenos) (Grasas y aceites) (Plástico) (Acumulación del plástico) (Plástico y salud humana) (Futuro del plástico) (Referencias)
Ángulos
de enlace
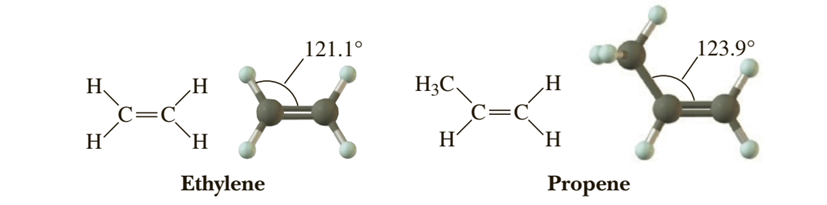
Usando la teoría de TREPeV para un doble
enlace carbono-carbono, predecimos un valor de 120° para los ángulos de enlace
alrededor de cada carbono. El ángulo de enlace H-C=C observado en el etileno es
de 121.1°, cercano al previsto. En otros alquenos, las desviaciones del ángulo
predicho de 120° pueden ser algo mayores debido a la deformación introducida
por las interacciones no enlazadas creadas por grupos enlazados a los carbonos
del doble enlace. El ángulo de enlace C-C-C en el propeno, por ejemplo, es 123.9°.
Figura 2‑1. Ángulos de enlace para el
doble enlace. Los dobles en las reducen en un lóbulo de repulsión de pares de
electrones de Valencia, por lo que la geometría molecular pasa a ser
tetraédrica a trigonal plana, en otras palabras, los dobles enlaces generan una
geometría plana entre los átomos que están vinculados.
Orbitales
Un doble enlace
carbono-carbono consta de un enlace sigma y un enlace pi. Cada carbono del doble enlace
usa sus tres orbitales híbridos sp2 para formar enlaces sigma con tres átomos,
generando tres lóbulos de repulsión. Los orbitales atómicos 2p no hibridados,
que se encuentran perpendiculares al plano creado por los ejes de los tres
orbitales híbridos sp2, se combinan para formar dos orbitales moleculares pi:
uno enlazante y otro antienlazante. Para que los orbitales 2p no hibridados sean
paralelos, dando así la máxima superposición, los dos átomos de carbono del
doble enlace y los cuatro átomos enlazados deben estar en un plano. Aunque esta descripción del doble
enlace parece complicada genera una conclusión importante y muy simple, el doble enlace no puede girar como si fuera un tornillo,
es una estructura rígida, que para rotar o romper se necesita cierta energía de
activación.
Se
necesitan aproximadamente 264 kJ (63 kcal)/mol para romper el enlace pi en el
etileno [es decir, para rotar un carbono 90° con respecto al otro donde ocurre
una superposición cero entre los orbitales 2p en carbonos adyacentes]. Esta
energía es considerablemente mayor que la energía térmica disponible a
temperatura ambiente; en consecuencia, la rotación alrededor de un doble enlace
carbono-carbono no ocurre en condiciones normales.
Puede
comparar la rotación sobre un enlace doble carbono-carbono, como en el etileno,
con la rotación sobre un enlace simple carbono-carbono, como en el etano.
Mientras que la rotación alrededor del enlace simple carbono-carbono en el
etano es relativamente libre [barrera de rotación de aproximadamente 12.5 kJ (3.0
kcal)/mol], la rotación alrededor del doble enlace carbono-carbono en el
etileno está severamente restringida. En otras palabras los enlaces simples entre
carbonos pueden girar como si fueran tornillos, y de hecho lo hacen libremente
porque la energía ambiente o calórica del sistema así lo induce.
Otra de las
consecuencias de la rigidez del enlace doble es el nacimiento de un nuevo tipo
de isomería, estamos hablando de los isómeros cis y trans.
Isómeros Cis/Trans
Debido a la
rotación restringida alrededor de un doble enlace carbono-carbono, cualquier
alqueno en el que cada carbono del doble enlace tiene dos grupos diferentes
unidos a él, muestra isomería cis, trans.
Figura 2‑2. Isómeros cis/trans del doble
enlace.
Aunque
parece una diferencia superficial cuando realizamos los modelos con las
estructuras de Lewis, con las fórmulas de esqueleto que representan de manera
más aproximada a la geometría molecular nos damos cuenta de un aspecto
importante, el doble enlace en posición trans genera una molécula lineal, mientras
que el doble enlace en posición cis hace que la molécula gire hacia un lado, y
una molécula torcida posee propiedades físicas y químicas diferentes de su
versión lineal. Ala isomería de posición cis y trans se la denomina como
isomería de diastereoisómeros; en la
cual tenemos la misma composición atómica, el mismo poder de enlace entre
átomos, pero una diferente configuración espacial tridimensional.
Los
alquenos cis con enlaces dobles en cadenas abiertas son menos estables que sus
isómeros trans debido a la tensión estérica entre los sustituyentes alquilo en
el mismo lado del enlace doble, lo anterior significa que si dos grupos
exactamente igual se encuentran muy cerca se repelen mutuamente, lo cual
aumenta la inestabilidad de la molécula como un todo.

No hay comentarios:
Publicar un comentario