El metano (CH4) y el etano (C2H6) son los
dos primeros miembros de la familia de los alcanos. La forma del metano es
tetraédrica con ángulos de enlace C-H de 109.58°. Cada átomo de carbono en el
etano también es tetraédrico y todos los ángulos de enlace son aproximadamente
109.58°. Aunque las formas tridimensionales de los alcanos más grandes son más
complejas que las del metano y el etano, los cuatro enlaces alrededor de cada
carbono todavía están dispuestos de forma tetraédrica y todos los ángulos de
enlace son aproximadamente 109.58°.
Figura 2‑1. A la izquierda estructurada
lo es para el metano, a la derecha modelo de bolas y palos donde se representa
la tridimensionalidad de la molécula.
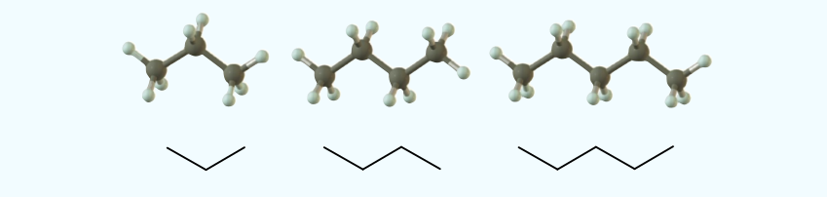
Los siguientes tres alcanos son propano (CH3CH2CH3),
butano (CH3CH2CH2CH3) y pentano (CH3CH2CH2CH2CH3).
También se dibujan en una forma aún más abreviada llamada fórmula de ángulo de línea. En una fórmula de
ángulo de línea, cada vértice y final de línea representa un átomo de carbono.
Aunque no mostramos los átomos de hidrógeno en las fórmulas de línea y ángulo,
suponemos que están allí en número suficiente para dar a cada carbono cuatro
enlaces.
Figura 2‑2. De izquierda a derecha
n-propano, n-butano y n-pentano.
Podemos escribir fórmulas estructurales para alcanos en otra forma
abreviada más. La fórmula semiestructural del pentano, por ejemplo, contiene
tres grupos CH2 en el medio de la cadena. Podemos recolectarlos y
escribir la fórmula estructural del pentano como CH3(CH2)3CH3.
Los alcanos tienen la fórmula molecular general CnH2n+2.
Así, dado el número de átomos de carbono en un alcano, podemos determinar el
número de hidrógenos en la molécula y su fórmula molecular. Por ejemplo, el
decano, con diez átomos de carbono, debe tener (2x10)+2=22 átomos de hidrógeno
y una fórmula molecular de C10H22, pero esa fórmula
molecular incluye al n-decano y todos sus isómeros.
Isómeros
constitucionales
Los isómeros constitucionales son compuestos que tienen la misma fórmula
molecular pero diferentes fórmulas estructurales. Por “diferentes fórmulas
estructurales” queremos decir que los isómeros constitucionales difieren en los
tipos de enlaces que tienen (simple, doble o triple) y/o en la conectividad de
sus átomos, pero poseerán el mismo número de átomos de cada elemento.
La teoría estructural les permitió a los primeros químicos orgánicos
comenzar a resolver varios problemas fundamentales que los acosaban. En
especial el problema del isomerismo. Estos químicos frecuentemente se
encontraban con ejemplos de diferentes sustancias que tenían las mismas
formulas moleculares pero que presentaban propiedades físicas y/o químicas
diferentes. A estas sustancias se las denominó isómeros. Consideremos un
ejemplo, tenemos dos compuestos con la formula molecular C4H10,
uno llamado butano (p.e. 1 °C p.f. −134 °C;) y el otro llamado isobutano
“2-metilpropano” (p.e. −11.7 °C p.f. −159.42 °C;), que son claramente
diferentes debido a sus diferentes propiedades.
Figura 2‑3. A la izquierda el butano y a
la derecha el 2-metilpropano.
Debido a que la fórmula molecular de ambos compuestos es la misma, esta no
nos sirve para entender las diferencias entre las propiedades físicas de ambas
sustancias. La teoría estructural remedia esta situación al adjudicarle a cada
sustancia una fórmula estructural diferente, con diferentes tipos de conexiones
entre los átomos.
Posteriormente en 1874 las fórmulas estructurales originadas por kekulé,
Couper y Butlerov fueron expandidas a las tres dimensiones por medio de
trabajos independientes de JD van´t Hoff
y JA Le Bel. Ambos propusieron que los hidrógenos en la molécula del metano (CH4)
se encontraban dispuestos como si estuvieran apuntando a las puntas de un
polímero regular llamado tetraedro. Hasta entonces a la molécula de metano se
la dibujaba plana como si fuera una cruz. El conocimiento de la disposición en
tres dimensiones de las moléculas es vital para el entendimiento de la química
orgánica y cualquier otra ciencia que dependa de ella como la bioquímica.
Los alcanos con más de tres átomos de carbono se pueden organizar de varias
formas, formando isómeros estructurales. El isómero más simple de un alcano es
aquel en el que los átomos de carbono están dispuestos en una sola cadena sin
ramificaciones. Este isómero a veces se denomina isómero n (n de
"normal", aunque no es necesariamente el más común o mas estable).
Sin embargo, la cadena de átomos de carbono también puede estar ramificada en
uno o más puntos. El número de posibles isómeros aumenta rápidamente con el
número de átomos de carbono.
En general para identificar isómeros constitucionales en un grupo de
decanos lo que debe hacer es (1) verificar que sean alcanos (2) contar el
número de carbonos (3) aplicar la fórmula CnH2n+2 (4) Y
verificar el número de hidrógenos.
Número de
isómeros
La capacidad de los átomos de carbono para formar enlaces fuertes con otros
átomos de carbono da como resultado un número asombroso de isómeros
constitucionales, que aumenta más que exponencialmente con el número de
carbonos. Hay 3 isómeros constitucionales con la fórmula molecular C5H12,
75 isómeros constitucionales con la fórmula molecular C10H22
y casi 37 millones con la fórmula molecular C25H52. Por
tanto, incluso para un pequeño número de átomos de carbono e hidrógeno, es
posible un gran número de isómeros constitucionales. Debido a que los isómeros
constitucionales tienen diferentes propiedades químicas, es posible una rica
diversidad química dentro de estos conjuntos. Algunas de estas agrupaciones o
isómeros son más estables que otras, e incluso algunas son naturales y otras
sólo se pueden obtener por síntesis artificiales. Sin embargo, el verdadero
problema que nos imponen los isómeros constitucionales radica en los nombres,
tener el alcano de 25 carbonos implica una enorme cantidad de isómeros y cada
uno debe tener su propio nombre.
Sin embargo, antes de discutir la nomenclatura, vamos a hablar un poco de
la historia de la fórmula CnH2n+2 y del cálculo del
número de isómeros, porque el hecho de que expongamos que el alcano de 25
carbonos tenga una cantidad de isómeros de casi casi 37 millones, no implica
que los químicos orgánicos dibujarán cada isómero individualmente. Ese trabajo
sólo pudo ser posible a través de álgebra analítica, es decir, la deducción de
una fórmula general que permite el cálculo rápido de los isómeros sin tener que
dibujar los uno por uno.
Isomerismo
óptico
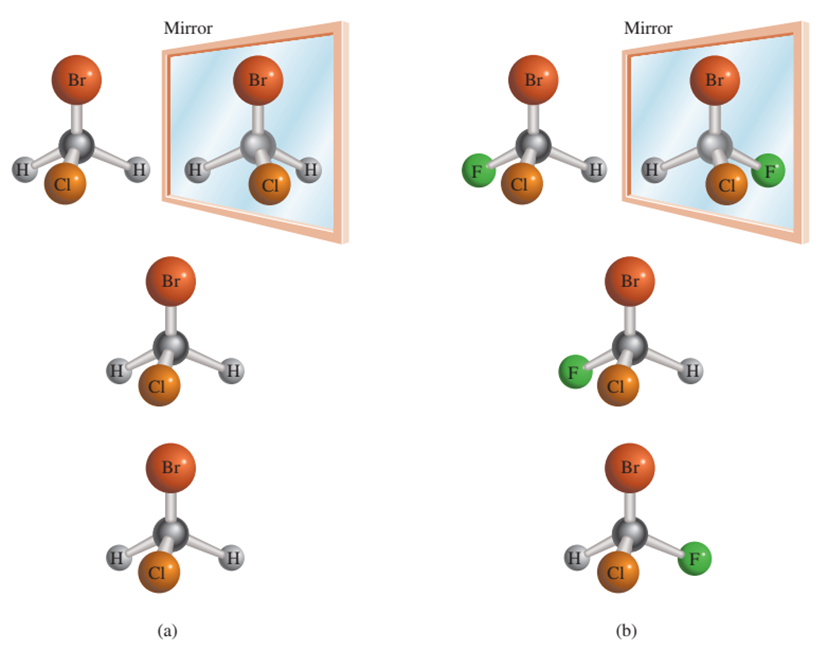
Los isómeros ópticos son compuestos que son imágenes especulares no
superponibles entre sí.
Figura 2‑4. (a) La molécula de CH2ClBr
y su imagen especular. Como la molécula y su imagen especular son
superponibles, se dice que la molécula es aquiral. (b) La molécula de CHFClBr y
su imagen especular. Como la molécula y su imagen especular no son
superponibles, por mucho que giremos una con respecto a la otra, se dice que la
molécula es quiral.
La figura 2-4. muestra dibujos en perspectiva de los metanos sustituidos CH2ClBr
y CHFClBr y sus imágenes especulares. Las imágenes especulares de CH2ClBr
son superponibles pero las de CHFClBr no lo son, sin importar cómo rotemos las
moléculas. Por lo tanto, la molécula de CHFClBr es quiral. La mayoría de las
moléculas quirales simples contienen al menos un átomo de carbono asimétrico,
es decir, un átomo de carbono unido a cuatro átomos o grupos de átomos
diferentes.


No hay comentarios:
Publicar un comentario